醫藥網(wǎng)7月27日訊 據不完全統計,今年上半年有39款新藥在我國獲批上市(不含中藥與疫苗類(lèi)產(chǎn)品),其中包括23款首次獲批的新藥,以及16款獲批新適應癥的產(chǎn)品。隨著(zhù)國家藥品監督管理局優(yōu)先審評審批制度的實(shí)施,不少產(chǎn)品審評審批速度加快,與上年同期相比,臨床急需境外新藥獲批數量有所增加。
生物藥領(lǐng)域迎來(lái)首款ADC藥物
在今年上半年批準的39款新藥中,21款為生物制劑(包括16款抗體藥物),18款為小分子化藥。按首次批準計算,上半年批準了10款生物藥,多為進(jìn)口產(chǎn)品。武田、羅氏、賽諾菲和協(xié)和發(fā)酵麒麟株式會(huì )社各有2款生物藥獲批(詳見(jiàn)表1)。
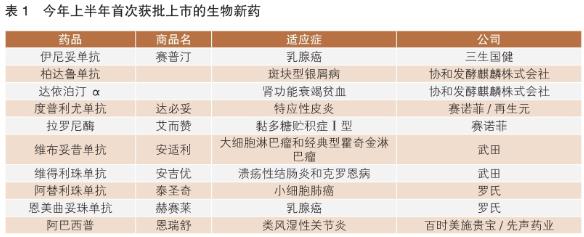
近年來(lái),不少新藥研發(fā)公司持續投入生物藥開(kāi)發(fā),創(chuàng )新產(chǎn)品相繼獲批上市,來(lái)自全球大型醫藥企業(yè)的創(chuàng )新生物藥產(chǎn)品為我國患者帶來(lái)更多治療選擇。
值得一提的是,今年1月我國首次批準了抗體偶聯(lián)藥物(ADC)恩美曲妥珠單抗上市——單藥用于HER2陽(yáng)性早期乳腺癌患者的輔助治療。4個(gè)月后,國家藥監局批準了第二款ADC藥物維布妥昔單抗,用于大細胞淋巴瘤(sALCL)和霍奇金淋巴瘤(cHL)的治療。
事實(shí)上,ADC藥物開(kāi)發(fā)并非一帆風(fēng)順。過(guò)去幾十年中,業(yè)界投入大量資源和精力改進(jìn)構建ADC技術(shù),有效提高了ADC藥物的獲益/風(fēng)險比。目前,全球已有8款ADC藥物獲批上市。此次國家藥監局批準恩美曲妥珠單抗和維布妥昔單抗上市,意味著(zhù)ADC這種創(chuàng )新療法已在我國落地。
修美樂(lè )、PD-1“豐收”新適應癥
每一款藥物的成功獲批都是科學(xué)家多年努力的成果,來(lái)之不易。如果它能擴展更多適應癥,則意味著(zhù)將有機會(huì )造福更多患者。
從今年上半年我國藥品審評審批情況來(lái)看,至少有16款創(chuàng )新藥產(chǎn)品獲得了新適應癥批準,其中5款為小分子化藥獲批新適應癥。如諾華的黑色素瘤聯(lián)合療法曲美替尼和達拉非尼、入局ALK陽(yáng)性局部晚期或轉移性非小細胞肺癌一線(xiàn)治療的塞瑞替尼,以及勃林格殷格翰獲批系統性硬化病相關(guān)間質(zhì)性肺?。⊿Sc-ILD)治療的尼達尼布。此外,還有輝瑞的西地那非獲批新適應癥——治療肺動(dòng)脈高壓(詳見(jiàn)表2)。

上半年,多款生物藥在我國成功拓展新適應癥。其中,艾伯維的全人源抗腫瘤壞死因子(TNFi)單克隆抗體阿達木單抗(修美樂(lè ))獲批新適應癥較多。作為艾伯維旗下重磅產(chǎn)品,該藥自2010年首次在我國獲批用于類(lèi)風(fēng)濕關(guān)節炎治療以來(lái),已相繼獲批7項適應癥——今年1月份獲批用于中重度活動(dòng)性成人克羅恩病治療;3月份獲批用于非感染性中間葡萄膜炎、后葡萄膜炎和全葡萄膜炎治療,該適應癥曾被納入臨床急需境外新藥名單;同月獲批用于兒童斑塊狀銀屑?。╬Ps)和多關(guān)節型幼年特發(fā)性關(guān)節炎(pJIA)治療。
此外,備受矚目的PD-1抗體斬獲更多適應癥。PD-1抗體等免疫檢查點(diǎn)抑制劑,通過(guò)與相應配體結合,消除對T細胞活性的抑制,從而提高T細胞殺傷腫瘤的能力。這類(lèi)療法問(wèn)世后,已被用于治療多種癌癥,并有望擴展至更多實(shí)體瘤和血液瘤的治療。
在我國,首個(gè)PD-1抗體獲批至今已有兩年時(shí)間。此間,相關(guān)企業(yè)努力為其布局更多新適應癥。上半年,PD-1抗體領(lǐng)域有6項新適應癥獲得批準。其中,恒瑞醫藥研發(fā)的卡瑞利珠單抗(艾瑞卡)收獲頗豐,該藥物先是在3月份獲批用于晚期肝細胞癌治療,成為我國企業(yè)研發(fā)的首個(gè)獲批肝癌適應癥的PD-1抑制劑。隨后,在6月份又一舉拿下肺癌、食管癌領(lǐng)域兩個(gè)適應癥。加上首個(gè)獲批的復發(fā)或難治性經(jīng)典型霍奇金淋巴瘤適應癥,目前卡瑞利珠單抗共獲批4大適應癥。
此外,百濟神州的替雷利珠單抗則通過(guò)優(yōu)先審評獲得第二項適應癥——尿路上皮癌,其另外3個(gè)適應癥也已提交上市申請;百時(shí)美施貴寶的Opdivo獲得了第三項適應癥——胃或胃食管連接部腺癌;默沙東的Keytruda獲得第五項適應癥——二線(xiàn)治療食管癌。
除以上品種外,還有安進(jìn)的地舒單抗、諾華的司庫奇尤單抗、楊森的烏司奴單抗、德國默克的西妥昔單抗、禮來(lái)的度拉糖肽、諾和諾德的利拉魯肽等多款生物藥斬獲新適應癥。
9款臨床急需境外新藥獲批
臨床急需境外新藥名單的公布及優(yōu)先審評審批制度的實(shí)施,加快了一些針對罕見(jiàn)病、嚴重危及生命或嚴重影響生活質(zhì)量的疾病治療藥物在我國上市速度。據不完全統計,自臨床急需境外上市藥品目錄發(fā)布至今,國家藥監局已批準36個(gè)品種進(jìn)口注冊。其中包括今年上半年批準的9款(詳見(jiàn)表3),與上年同期相比,批準數量有所增長(cháng)。往年獲批情況顯示,一般情況下下半年獲批數量均超過(guò)10款,預計今年全年將會(huì )有更多臨床急需境外新藥在我國獲批上市。
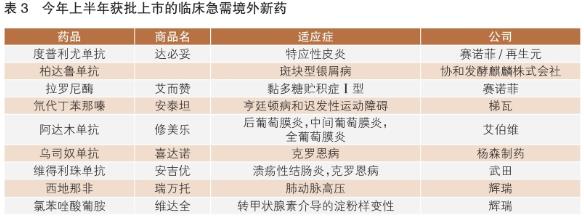
值得一提的是,輝瑞普強旗下枸櫞酸西地那非片上市申請2019年9月獲國家藥監局藥品審評中心(CDE)受理,2020年2月即通過(guò)優(yōu)先審評獲批上市,歷時(shí)僅4個(gè)半月,成為在我國首個(gè)被批準用于治療肺動(dòng)脈高壓的5型磷酸二酯酶(PDE-5)抑制劑,當屬臨床急需境外新藥在我國成功獲得加速批準的典型范例。
在這些獲批的臨床急需境外新藥中,有多款“首個(gè)”值得關(guān)注。賽諾菲近日獲批的重磅抗炎療法度普利尤單抗注射液,是全球首個(gè)也是唯一獲批治療成人中重度特應性皮炎的靶向生物制劑;注射用拉羅尼酶濃溶液是全球首個(gè)、目前唯一獲準治療黏多糖貯積癥Ⅰ型(MPSⅠ)的酶替代療法,同時(shí)也是我國唯一治療MPSⅠ的特異性治療藥物。梯瓦公司用于治療與亨廷頓?。℉D)有關(guān)的舞蹈病及成人遲發(fā)性運動(dòng)障礙(TD)的創(chuàng )新藥物氘代丁苯那嗪片,則是國家藥監局和美國FDA批準的第一個(gè)氘代產(chǎn)品。
本土創(chuàng )新藥企業(yè)成績(jì)喜人
在39款獲批新藥中,有9款產(chǎn)品屬于我國本土創(chuàng )新企業(yè),其中7款為首次獲批。它們是百濟神州的BTK抑制劑澤布替尼、北??党傻腍ER2陽(yáng)性乳腺癌藥物奈拉替尼、豪森藥業(yè)的非小細胞肺癌治療藥物阿美替尼、凱因科技的丙型肝炎藥物鹽酸可洛派韋膠囊、銀谷制藥的過(guò)敏性鼻炎藥物苯環(huán)喹溴銨鼻噴霧劑、復星醫藥首個(gè)引進(jìn)的血小板減少癥新藥阿伐曲泊帕、三生國健藥業(yè)乳腺癌新藥伊尼妥單抗。其中,北??党傻哪卫婺岷蛷托轻t藥的阿伐曲泊帕均為從海外引進(jìn)的產(chǎn)品。
百濟神州澤布替尼的獲批備受關(guān)注。該品于今年6月在我國通過(guò)優(yōu)先審評審批程序附條件批準上市,首次獲批兩項適應癥,包括套細胞淋巴瘤(MCL)和慢性淋巴細胞白血?。–LL)/小淋巴細胞淋巴瘤(SLL)。此外,它還是首個(gè)獲得美國FDA授予“快速通道”“加速審評”“突破性療法”和“優(yōu)先審評”四大特殊通道資格認定的中國自主研發(fā)抗癌新藥,去年11月率先在美國獲批。
此外,凱因科技開(kāi)發(fā)的國產(chǎn)1類(lèi)新藥鹽酸可洛派韋膠囊,通過(guò)抑制NS5A蛋白而阻斷HCV病毒的復制和組裝,于今年2月在我國獲批用于治療成人慢性丙型肝炎病毒(HCV)感染。




